Proceso termodinámico
En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final. De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre sí.
De una manera menos abstracta, un proceso termodinámico puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales, debido a su desestabilización.
Tipos de procesos termodinámicos
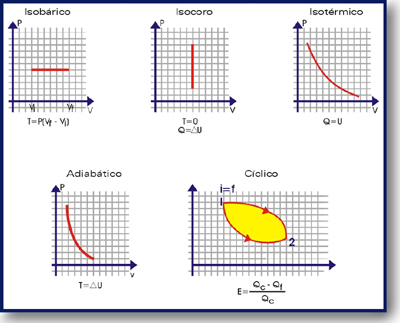
Procesos Iso
Son los procesos cuyas magnitudes permanecen "constantes", es decir que el sistema cambia manteniendo cierta proporcionalidad en su transformación. Se les asigna el prefijo iso-.
Ejemplo:
- Isotérmico: proceso a temperatura constante
- Isobárico: proceso a presión constante
- Isométrico o isocórico: proceso a volumen constante
- Isoentálpico: proceso a entalpía constante
- Isoentrópico: proceso a entropía constante

PRIMERA LEY DE LA TERMODINAMICA.
Esta ley dice que la variación de la energía interna de un sistema es igual a la energía que transfieren o reciben los alrededores en forma de calor y trabajo, de forma tal que se cumple la energía no se crea ni se destruye, solo se transforma.
La primera ley de la termodinámica se muestra matemáticamente de la siguiente manera:
Esta ley dice que la variación de la energía interna de un sistema es igual a la energía que transfieren o reciben los alrededores en forma de calor y trabajo, de forma tal que se cumple la energía no se crea ni se destruye, solo se transforma.
La primera ley de la termodinámica se muestra matemáticamente de la siguiente manera:

a) Peso termodinámico:
Es cuando la temperatura, presión o volumen de un gas varían. Los procesos termodinámicos se clasifican en:
Es cuando la temperatura, presión o volumen de un gas varían. Los procesos termodinámicos se clasifican en:
PROCESO ISOTERMICO:
Se presenta cuando la temperatura del sistema, permanece constante independientemente de los cambio de presión o volumen que sufran.
Se presenta cuando la temperatura del sistema, permanece constante independientemente de los cambio de presión o volumen que sufran.

Este proceso se rige por la ley de Boyle-Mariotte de Robert Boyle (1626-1691), Físico Químico irlandés conocido por sus experimentos acerca de las propiedades de los gases
y Edme Mariotte (1620-1684), Físico Francés que descubrió la ley que relación la presión y el volumen de los gases a temperatura constante.
y Edme Mariotte (1620-1684), Físico Francés que descubrió la ley que relación la presión y el volumen de los gases a temperatura constante.
Si un proceso isotérmico formado por un gas experimenta una expansión isotérmica, para que la temperatura permanezca constante la cantidad de calor recibido debe ser igual al trabajo que realiza durante la expansión. Pero si presenta una compresión isotérmica, para que la temperatura también permanezca constante el gas tiene que liberar una cantidad de calor igual al trabajo desarrollado sobre él.
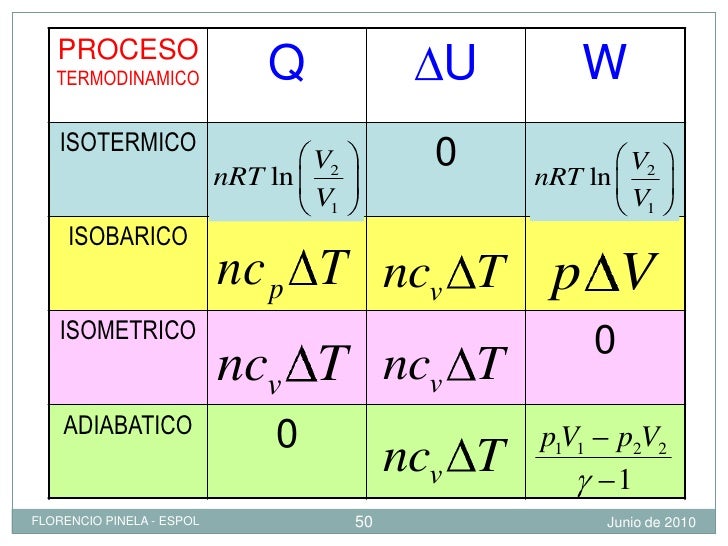
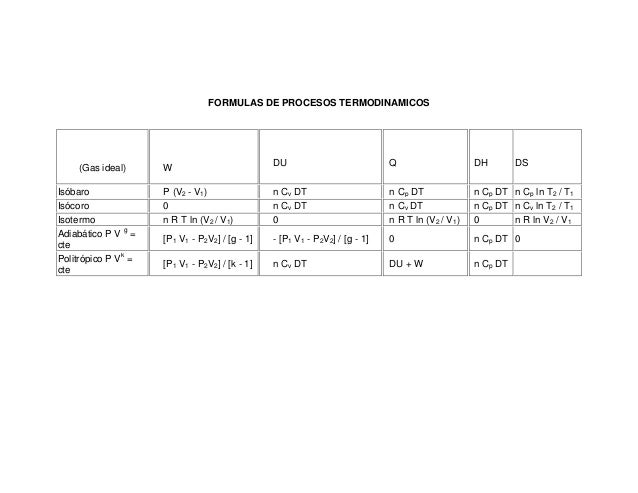
La temperatura no cambia, su energía interna (Ei), son constantes y su variación de energía interna (ΔEi) es igual a cero, por lo que se cumple que (Ei es constante) (ΔEi = 0 ) Q=Tr.
La temperatura no cambia, su energía interna (Ei), son constantes y su variación de energía interna (ΔEi) es igual a cero, por lo que se cumple que (Ei es constante) (ΔEi = 0 ) Q=Tr.
PROCESO ISOBARICO:
Es cuando hay una variación del volumen o temperatura y la presión permanece constante, no importando si el gas sufre una compresión o una expansión. Este proceso rige por la Ley de Charles: Jackes A. Charles ( 1742-1822). Químico, físico y aeronauta Frances, que fue el primero en hacer mediciones acerca de los gases que se expanden al aumentar la temperatura.
Las ecuaciones para el proceso isobárico son:
Es cuando hay una variación del volumen o temperatura y la presión permanece constante, no importando si el gas sufre una compresión o una expansión. Este proceso rige por la Ley de Charles: Jackes A. Charles ( 1742-1822). Químico, físico y aeronauta Frances, que fue el primero en hacer mediciones acerca de los gases que se expanden al aumentar la temperatura.
Las ecuaciones para el proceso isobárico son:

PROCESO ISOCORICO:Se presenta cuando el volumen del sistema permanece constante. Ya que la variación del volumen es cero, no se realiza trabajo sobre el sistema ni de éste último de sobre los alrededores, por lo que se cumple Tr = 0 Y ΔEi = Q, esto indica que todo el calor suministrado aumentara en la misma proporción a la energía interna, en general esto se presenta cuando un gas se calienta dentro de un recipiente con volumen fijo.
Cuando se calientan dos masas iguales de gas, a una presión constante y otra a volumen constante, para que logren el mismo incremento de temperatura se requiere proporcionar mayor calor al sistema a presión constante (Qp>Qv). Ello se debe a que en el proceso isobárico el calor suministrado se usa para aumentar la energía interna y efectuar trabajo, mientras que en el proceso isocórico todo el calor se usa para incrementar exclusivamente la energía interna.
Cuando se calientan dos masas iguales de gas, a una presión constante y otra a volumen constante, para que logren el mismo incremento de temperatura se requiere proporcionar mayor calor al sistema a presión constante (Qp>Qv). Ello se debe a que en el proceso isobárico el calor suministrado se usa para aumentar la energía interna y efectuar trabajo, mientras que en el proceso isocórico todo el calor se usa para incrementar exclusivamente la energía interna.
PROCESO ADIABATICO:
Ocurre cuando el sistema no crea ni recibe calor, cumpliéndose que (Q=0) y ΔEi = -Tr , aun cuando el gas puede presentar expansión o comprensión.
En resumen las condiciones que se tienen que cumplir para los procesos son termodinámicos son:


FORMULAS
EJERCICIOS
PROBLEMA 1 Ciclo de Carnot
Un ciclo de Carnot se realiza entre las isotermas TC = 400 K y TF = 300 K. Durante la expansión
isotérmica se comunica al gas ideal el calor QC = 500 cal. Se pide calcular:
1) El trabajo efectuado durante la expansión isotérmica.
2) El calor extraído del gas durante la compresión isotérmica.
3) El trabajo realizado por el gas durante la compresión isotérmica.
4) El rendimiento del ciclo
Solución
1) W = - QC = -2090 J
2) QF = - QC (TF / TC) = -1567.5 J
3) W = - QF = 1567.5 J
4) η = 1 - (TF / TC) = 0.25
No hay comentarios.:
Publicar un comentario