Tipos de procesos termodinámicos
Procesos termodinámicos que se dan con frecuencia en situaciones prácticas, los cuales son:
- Proceso Adiabático: Es uno en el que no entra ni sale calor del sistema; Q=0. Podemos evitar el flujo de calor ya sea rodeando el sistema con material térmicamente aislante o realizando el proceso con tal rapidez que no haya tiempo para un flujo de calor apreciable. Por la primera ley, para todo proceso adiabático,
Cuando un sistema se expande adiabáticamente, W es positivo (el sistema efectúa trabajo sobre su entorno), así que es negativo y la energía interna disminuye, y cuando se comprime adiabáticamente es todo lo contrario.
- Proceso Isocórico: Se efectúa a volumen constante. Si el volumen de un sistema termodinámico es constante, no se realiza trabajo sobre su entorno; W=0 y
En un proceso isocórico, toda la energía agregada como calor permanece en el sistema como aumento de energía interna.
- Proceso Isobárico: Se efectúa a presión constante. En general, ninguna de las tres cantidades: es cero en un proceso isobárico, pero aun así es fácil calcular W, entonces se tiene
- Proceso Isotérmico: Se efectúa a temperatura constante. Para ello, todo intercambio de calor con el entorno debe efectuarse con tal lentitud para que se mantenga en equilibrio térmico.
La energía interna de un sistema depende únicamente de su temperatura, no de su presión ni su volumen. El sistema mas conocido que posee esta propiedad especial es el gas ideal. En tales sistemas, si la temperatura es constante, la energía interna también lo es; ΔU=0 y Q=W. Es decir, toda la energía que entre en el sistema como calor Q debería salir como trabajo W efectuado por el sistema.
PROBLEMAS
Se sitúan 15 L de gas ideal en un recipiente a 27 ºC. El recipiente cuenta con un pistón móvil libre de rozamiento. La presión en el exterior se mantiene constante a 750 mmHg. Determina, si se eleva la temperatura a 190 ºC:
Datos : cv = 5·R/2 ; R = 8.31 J/ mol·K
Resolución
1.
En los procesos a presión constante el trabajo termodinámico, según el criterio de signos establecido, viene dado por la expresión:
Para determinar el volumen final podemos aplicar la ecuación de estado de los gases ideales, de la siguiente manera:
La expresión anterior constituye la ley de Charles y Gay-Lussac. A partir de ella, nos queda:
Y volviendo a la expresión del trabajo termodinámico nos queda:
2.
Presta atención a este apartado por que vamos a utilizar una serie de conceptos que debes tener claros. En primer lugar, la variación de energía interna en un gas depende únicamente de la variación de temperatura. En el diagrama p - V de la figura puedes ver representadas las dos isotermas características del proceso.
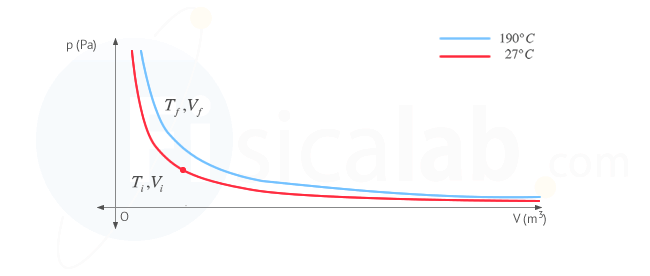
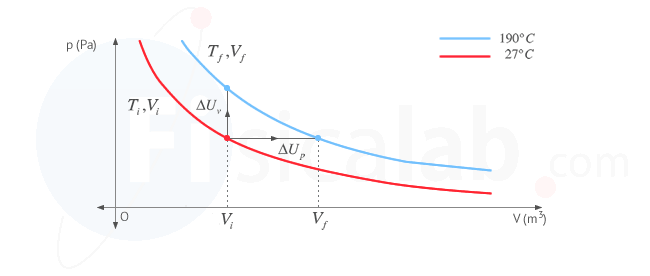
En el proceso, al variar la temperatura varía la energía interna, es decir, nos desplazamos de una isoterma a otra realizando un determinado trabajo y transfiriendo un determinado calor. Independientemente de la forma en que nos desplacemos de una isoterma a otra (esto es, la cantidad de calor y trabajo que intervenga en el proceso), la variación de energía interna dependerá unicamente de la isoterma inicial y la isoterma final. Es por ello que, dado que nos dan como dato cv (calor específico a volumen constante), estudiaremos la variación de energía interna suponiendo un proceso isocórico ( a volumen constante ) donde el volumen no cambia y, por tanto, el desplazamiento de una isoterma a otra se realizaría exclusivamente mediante el intercambio de calor, al ser el trabajo realizado cero ( W = 0 ) . De esta forma, nos queda:
Por otro lado, dado que nos dan cv referida a cantidad de sustancia ( mol ), utilizaremos, para el cálculo del calor, la expresión:
Observa que ya habíamos presentado en teoría dicha expresión al hablar de la variación de energía interna de un gas cuando se incrementa la temperatura.
Para el cálculo de n aplicamos de nuevo la ecuación de estado de los gases ideales:
Finalmente, volviendo a la ecuación de la variación de energía interna en un proceso isocórico, tenemos:
En la siguiente figura se representa el proceso que tendría lugar a volumen constante y que nos sirve para determinar la variación de energía interna también en nuestro proceso a presión constante.
 |



No hay comentarios.:
Publicar un comentario